FAQよくあるご質問
よくあるご質問
企業情報
創業はいつですか?
1999年12月17日です。
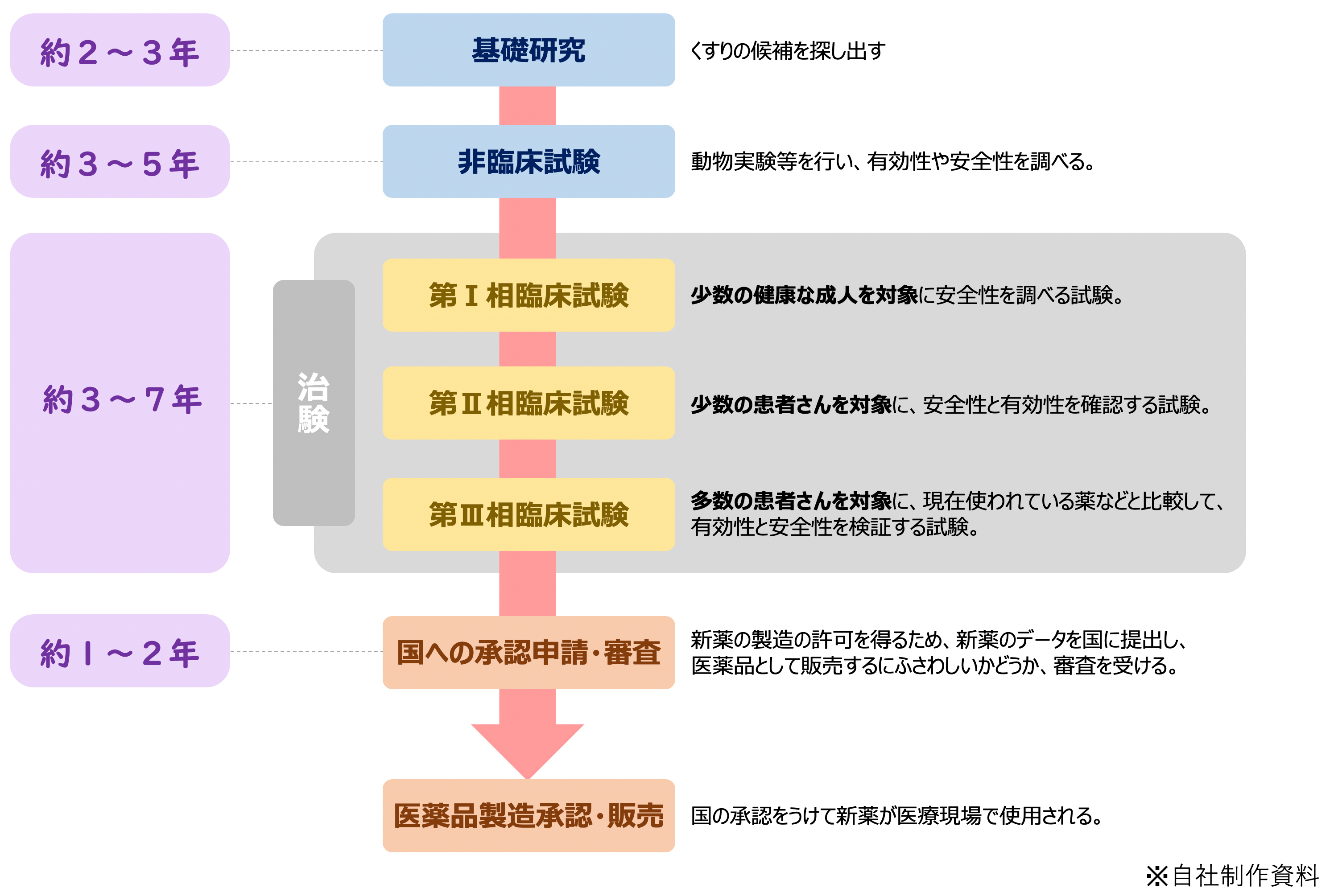
薬を開発するには、何にどのぐらいの時間がかかるのでしょうか?
アンジェスの名前の由来は?
- Aspiration(志)
- 挑戦する精神と熱意を持ち続け、変化を恐れずに自ら変革者となります。
- Network(ネットワーク)
- 患者さん、医療関係者、株主・投資家、提携企業、社員、地域社会といったネットワークの重要性を認識し大切にします。
- Genesis(創生)
- 常に最先端の研究成果と考え方を取り入れ、新しい技術と製品、価値の創生を目指します。
- Ethics(倫理)
- 最高の倫理観をもって業務に臨みます。
- Speed(スピード)
- 革新的な遺伝子医薬品をできるだけ早く実現し、必要とする患者さんに届けます。
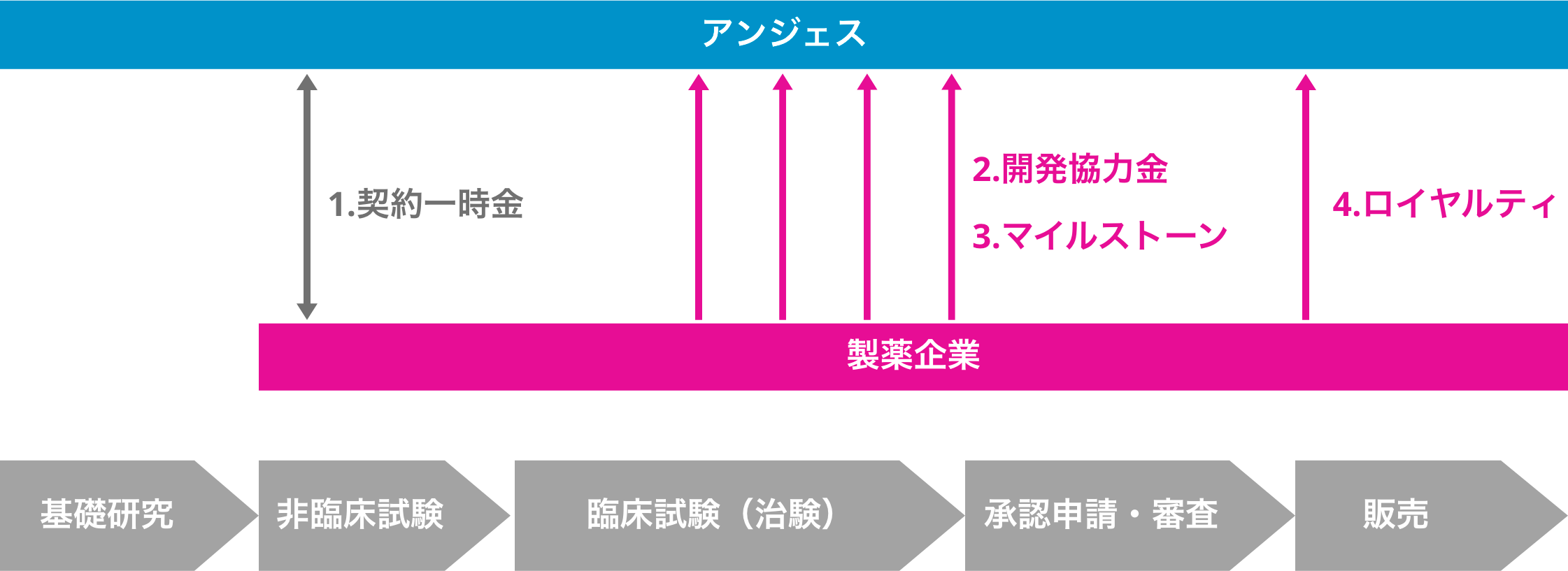
どのようなビジネスモデルですか?
決算・財務関連
決算発表はいつですか?
・第1四半期決算発表は、5月上旬ごろ
・第2四半期決算発表は、8月上旬ごろ
・第3四半期決算発表は、11月上旬ごろ
・決算発表は、2月上旬ごろ に行っています。
決算期はいつですか?
12月です。
決算資料はどこで確認できますか?
下記ページをご覧ください。
過去の業績はどこで確認できますか?
下記ページをご覧ください。
決算説明会はいつですか?
機関投資家・アナリスト向けに、本決算(2月頃)、第2四半期(8月頃)の年2回開催しています。
株式情報
株式が上場されたのはいつですか?
2002年9月に、東京証券取引所マザーズに上場しました。
上場取引所はどこですか?
東京証券取引所グロースです。
證券コードは何ですか?
4563です。
取引の単位(1単位)は何株ですか?
100株です。
配当はありますか?
現在はございません。
株主優待制度はありますか?
毎年6月30日及び12月31日現在の当社株主名簿に記載された1単元株式(100株)以上を保有されている株主様を対象として、当社が指定する商品を特別価格で購入できる「株主優待専用申込書」をご所有株式数に応じて年2回贈呈しています。
下記ページをご覧ください。
株主優待はいつ届きますか?
半期毎に開催する会社説明会のご案内と一緒に郵送します。
株式の諸手続きについての問い合わせ先はどこですか?
下記ページをご覧ください。
株主関連
株主総会はいつですか?
毎年3月に大阪で開催しています。
議決権行使をするためにはどうすればいいですか?
株主総会基準日(12月末日)時点の株主名簿に記載されている株主様に対して、株主総会の招集通知と議決権行使書をお送りしております。
議決権の行使の方法等は、招集通知でご案内しております。
その他企業全般
IRに関する問い合わせ先はどこですか?
下記ページから受け付けております。なお、多くいただきましたご質問には、当ホームページ上のブログやFAQなどで公開させていただきます。
事業関連
HGF遺伝子治療用製品
HGFとはなんですか?
肝細胞増殖因子(Hepatocyte Growth Factor)で肝臓の細胞を増やす働きをもったタンパクとして発見されましたが、大阪大学の研究室が肝細胞だけでなく血管を新生作用もあることを見出しました。
重症虚血肢とはなんですか?
慢性動脈閉塞症(足の動脈が狭くなったり、詰まったりする病気)のうち、足の安静時疼痛や潰瘍および壊死などを伴う状態のことです。
その他血管疾患との関連性は、こちらのブログをご参照ください。
閉塞性動脈硬化症とはなんですか?
コラテジェン®(潰瘍)の日本国内での本承認はいつごろになりそうですか?
市販後調査の結果をもって改めて申請を行います。本承認に向け申請しましたらご報告いたします。
米国での治験の状況は?
閉塞性動脈硬化症の下肢切断リスクの少ない潰瘍改善を対象とし、第Ⅲ相試験での用法用量を決める小数例の後期第Ⅱ相臨床試験を実施しており、投与症例数は目標症例数の8割を超えております。
合わせて、こちらのブログもご参照ください。
血管疾患に対するグローバルの新しいガイドラインとは?
治療介入をすべき病態を下肢切断のリスクから分類し病態に応じた積極的治療を推奨しているGVG™(Global Vascular Guidelines)になります。
合わせて、こちらのブログもご参照ください。
FDAとはなんですか?
アメリカ食品医薬品局(Food and Drug Administration)の略称で、医薬品や食品などを取り締まるアメリカ合衆国の政府機関です。例えると日本の厚生労働省に似た役割を持っています。
FDAは、消費者が通常の生活を行う際に接する機会がある様々な製品(食品、医薬品、動物薬、化粧品、医療機器、玩具など)の安全性・有効性を確保するための機関です。
米国ではいつ頃製品化できそうですか?
後期第Ⅱ相臨床試験の結果次第となりますが、進捗がありましたら適時開示いたします。
HGF遺伝子治療用製品の米国での臨床試験開始に関して、すでに承認されている潰瘍に関する日本のデータは使えないのでしょうか?
日本でのデータはあくまでも参考資料となりまして、改めて米国での試験評価が必要となります。そのため今回の試験を実施する必要があります。
米国での販売はどうするのですか?
米国での販売権は国内と同様、田辺三菱製薬株式会社と契約しています。
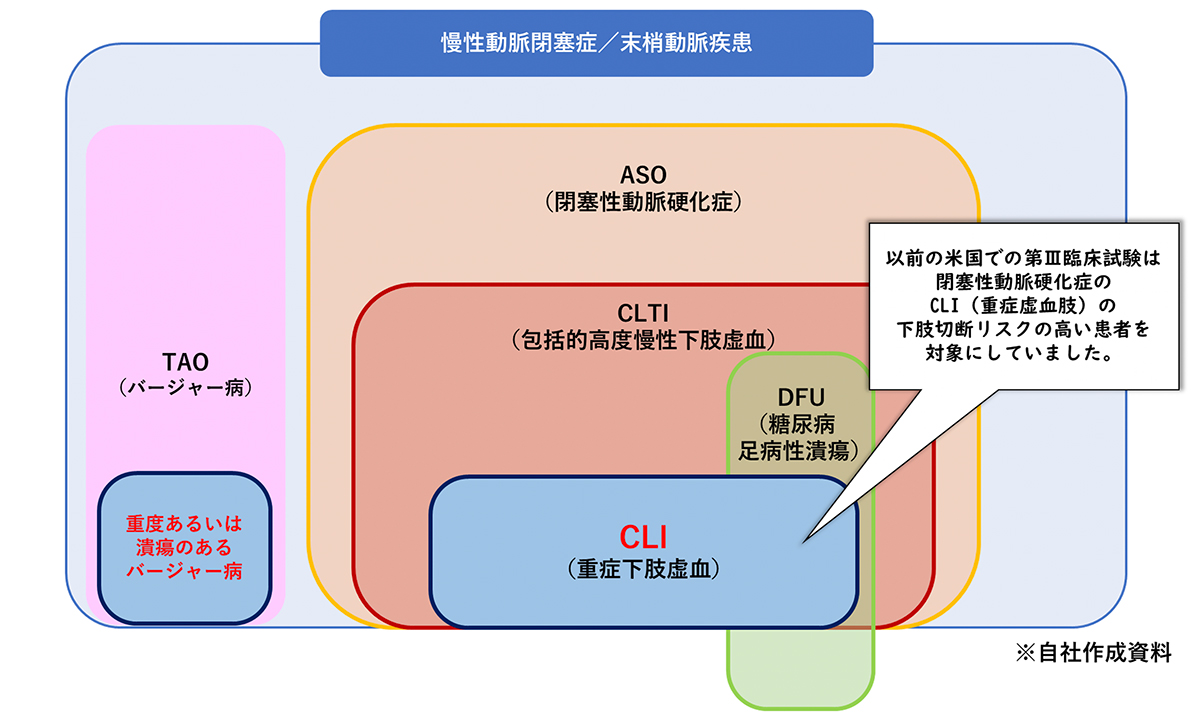
米国での臨床試験は、新たなガイドラインに沿った治験を実施中とのことですが、旧来の方法とどこが違うのかを教えてください。
旧来の方法との違いは、治験の対象を広げ、下肢切断リスクの低い患者も対象にしている点です。
以前の米国での第Ⅲ相臨床試験は、閉塞性動脈硬化症のCLI(重症虚血肢)の下肢切断リスクの高い患者を対象にしていました。
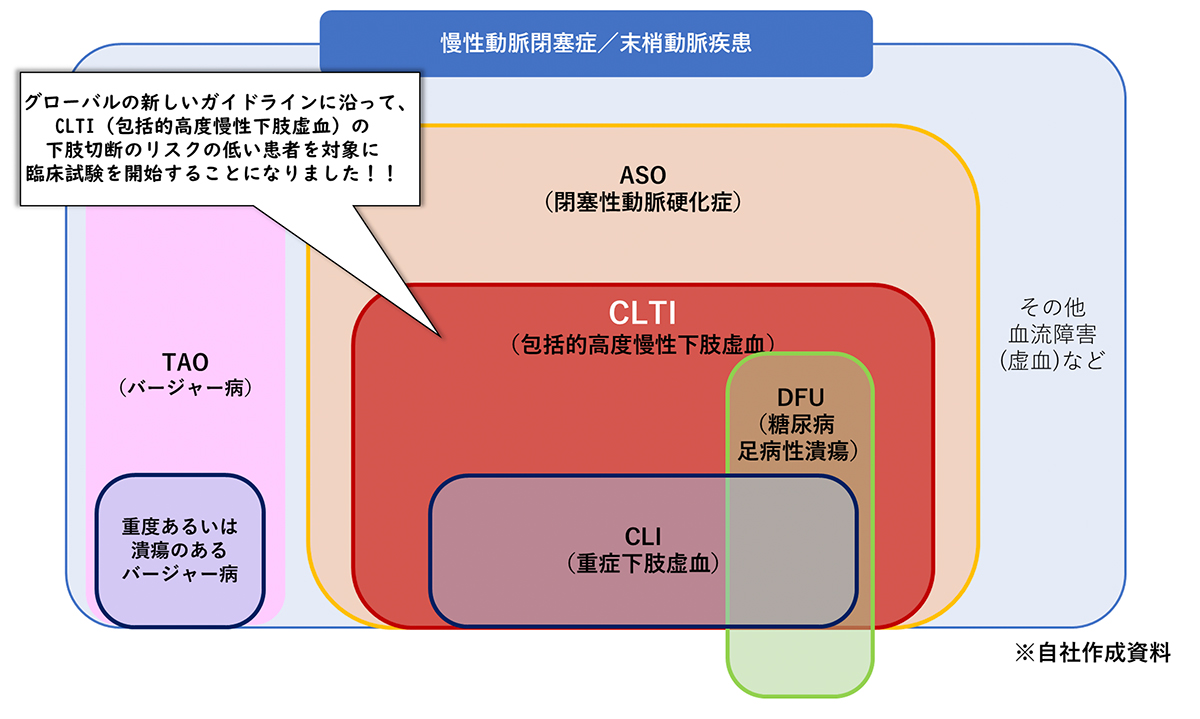
しかし、2019年6月に改定された新しいグローバルガイドライン(Global Vascular Guideline)では、血管疾患の臨床診療において、まさに足を切断するかしないかを迫られるまでの重度血管疾患であるCLIの患者だけを対象にするのではなく、より広い観点で血管疾患の中でも比較的高度のCLTIを対象とした治療法を見つめなおさなければいけないという考え方が推奨されるようになり、現在は、CLTI(包括的高度慢性下肢虚血)の下肢切断のリスクが低い患者も含め対象として治験を実施しています。
HGF遺伝子治療用製品の米国治験の進捗は想定と比べて順調に進んでいますか?
登録数・施設数なども含めてご教示いただけますでしょうか?
新型コロナウイルス感染症の影響で、一時患者登録が滞っていましたが、施設数を増やすなどの対策をして、登録状況は徐々に回復し予定数の8割を超えてきています。
HGF遺伝子治療用製品の米国でのフェーズ2bのスケジュール感と、その結果はいつ頃分かりますか?
米国でのフェーズ2b試験は2023年初めまで投与し、その後12か月間経過観察し、2024年に結果が出る予定です。
適応追加の安静時疼痛に関する進捗状況を教えてください。
NF-κBデコイオリゴDNA
NF-κBデコイオリゴDNAとはなんですか?
どのような症状向けに開発していますか?
椎間板性腰痛症を対象としています。
いつ頃製品化できそうですか?
2018年2月より米国にて第1相臨床試験を実施中です。
米国での治験は順調に進んでいるのでしょうか?
第Ⅰ相臨床試験は完了しており、現在今後の開発計画を検討中です。
高血圧DNAワクチン
高血圧DNAワクチンとはなんですか?
血圧上昇の作用を持つ体内物質である「アンジオテンシンⅡ」に対する抗体を体内で作り出し、その(アンジオテンシンⅡの)働きを抑えることで高血圧を治療するワクチンです。
合わせて、こちらもご確認ください。
これはどんな病気に有効ですか?
軽症から中等症の本態性高血圧患者を対象とします。
いつ頃製品化できそうですか?
現在オーストラリアにおいて、高血圧の症状の患者さんを対象に第Ⅰ相および前期第Ⅱ相の治験を実施中です。そのあと後期第Ⅱ相、第Ⅲ相治験を行い、承認申請に進める予定としています。
高血圧DNAワクチンの臨床試験を現在、オーストラリアで進めていますが、臨床試験の進捗状況はいかがですか?
第Ⅰ/Ⅱ相臨床試験は完了しており、現在今後の開発計画を検討中です。
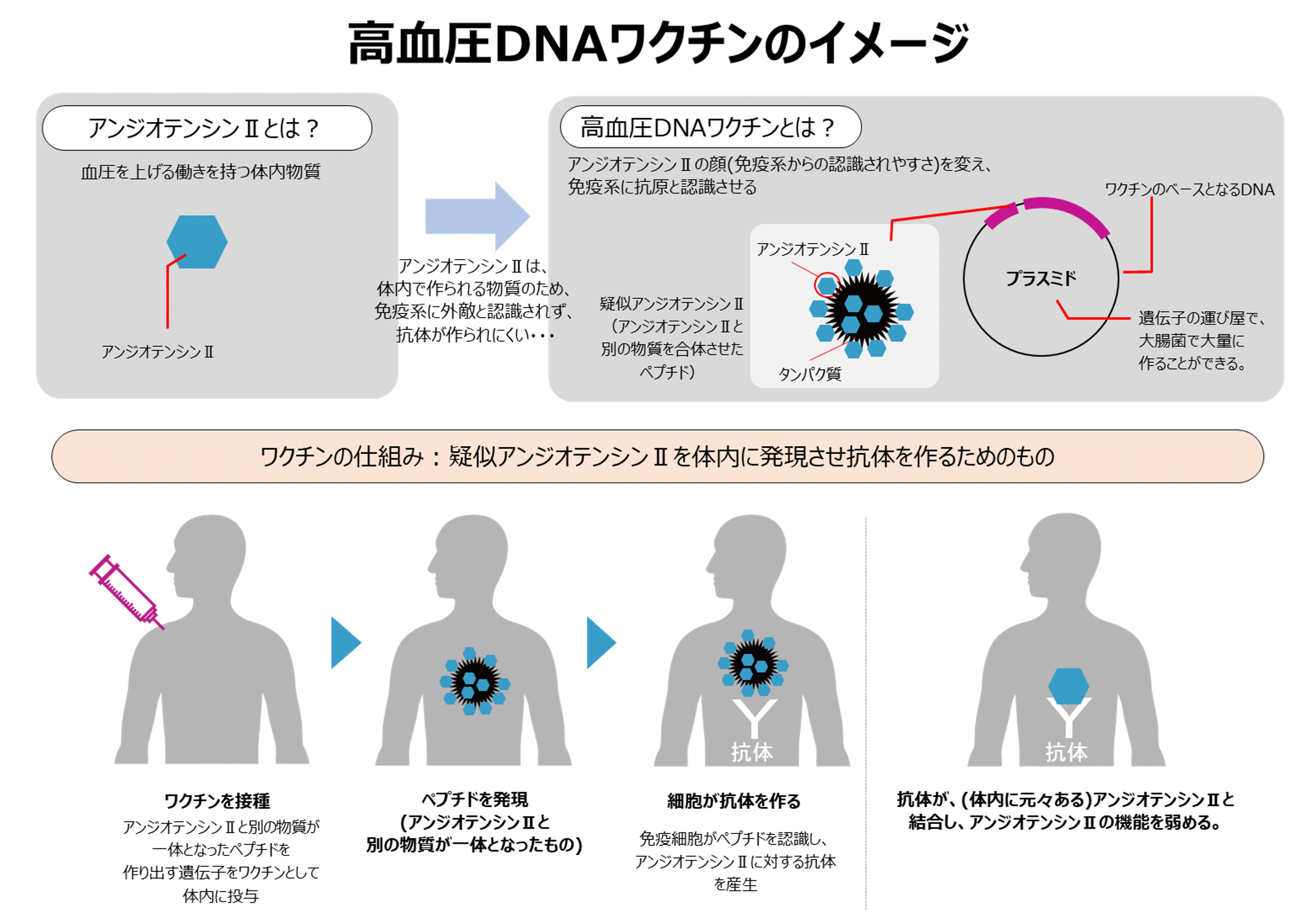
高血圧DNAワクチンの仕組みを教えてください。
血圧上昇の作用を持つ体内物質である「アンジオテンシンⅡ」に対する抗体を体内で作り出し、その(アンジオテンシンⅡの)働きを抑えることで高血圧を治療することを目的に開発を進めています。
<高血圧DNAワクチンの仕組み>
体内では、アンジオテンシンⅡが、異物と認識されず、抗体が作られないため、アンジオテンシンⅡの配列を短くしたペプチドを作って体外から投与することにより、抗原だと思わせて、抗体を作ります。その抗体が、(体内に元々ある)アンジオテンシンⅡと結合し、アンジオテンシンⅡの機能を弱めることで血圧が上昇するのを抑制する、という仕組みです。
CIN治療ワクチン
森下仁丹へライセンスアウトしたCIN治療ワクチンの進捗状況を教えてください。
当社が保有する権利(韓国のBioLeaders CorporationよりCIN治療ワクチンに関する日米英中の開発、製造、使用および販売の独占的実施権を取得)を森下仁丹株式会社に独占的に再許諾する契約を締結しております。
ナグラザイム
新型コロナウイルス感染症DNAワクチン
新型コロナウイルス感染症向けDNAワクチンの進捗状況を教えてください。
これまで開発していたDNAワクチンの開発については、2022年9月7日のリリースのとおり、開発を中止いたしました。
現在は、プラスミドの発現効率や導入効率の向上など、プラットフォームの見直しを行い、ウイルスの増殖防止、拡散の阻止が期待される経鼻投与製剤の開発を開始いたしました。
Tie2受容体アゴニスト(AV-001)
Tie2受容体アゴニスト「AV-001」とはなんですか?
カナダのバイオ医薬品企業であるVasomune(バソミューン)社と共同開発を進めている急性呼吸不全など血管の不全を原因とする疾患を対象とした医薬品です。中等度から重度のCOVID-19肺炎患者の治療薬として、2020年より米国で臨床試験を開始しています。
Vasomune社とは、どのような会社ですか?
病気から体を守る能力を高める次世代の医薬品を開発するカナダのトロントのバイオ医薬品企業です。Vasomune社は2006年に設立され、血管の正常化戦略に焦点を当てた新しい治療法を用いて医薬品を発見し、開発しています。血管機能障害は、COVID-19、インフルエンザ関連ARDS、急性肺損傷、急性腎損傷、出血性ショック、敗血症、脳卒中など、いくつかの疾患状態の病態と関連しています。
「AV-001」承認のおおよその時期を教えてください。
米国の規制当局であるFDA(アメリカ食品医薬品局)等と協議しながら、なるべく速やかに承認を取得できるよう開発を進めてまいりたいと考えております。
「AV-001」は、前期第II相臨床試験の結果を開示する予定はありますか?
後期第II相臨床試験を開始する時は、前期第II相臨床試験の結果をなんらかの形で開示する前提で進めることになります。
前期第II相臨床試験の登録状況は開示する予定はありますか?
前期第II相臨床試験の登録状況に関して、現時点では開示予定はございません。
ゲノム編集
ゲノム編集とはなんですか?
特定の塩基配列(ターゲット配列)のみを切断するDNA切断酵素(ヌクレアーゼ)を利用して、思い通りに遺伝子を改変する技術のことです。
Emendo社とは、どのような会社ですか?
2015年12月に設立した、イスラエルを拠点とする米国のバイオ企業。
重篤な疾患や障害の原因となる遺伝子異変を修復、除去することができるゲノム編集技術の開発を行っています。
当社とは2019年3月から資本提携をしており、2020年12月付で100%子会社となりました。
オフターゲット効果とはなんですか?
オフターゲット効果とは、標的配列(ターゲット配列)に似た配列を持つ、ターゲットではない部分の遺伝子を切断してしまうこと。
オフターゲット効果を低減させるために、
・ゲノム内に標的配列に類似した配列がないか検索
・類似配列が存在する標的は避け、別の標的配列を探すことが求められています。
アレル特異的遺伝子編集とはなんですか?
私たちは皆、基本的に同じ塩基配列の父方と母方の対(つい)をなす対立遺伝子を持っていますが、遺伝子疾患は、父方と母方、両方の遺伝子に異常がある場合や父方もしくは母方のどちらかの遺伝子だけに異常がある場合があります。
このように対になった遺伝子のうち、どちらかの遺伝子だけに異常がある場合、変異のある遺伝子のみを破壊するアレル特異的遺伝子編集が必要となります。アレル特異的遺伝子編集とは、対をなす対立遺伝子の一方を傷つけることなく、異常のある遺伝子のみをターゲットにして編集できることです。
Emendo社の技術の優位性はどんな点ですか?
優位性は主に2点あります。
まずは、オフターゲット効果の回避ができる点です。エメンド社では、より精度高く、誘導された特定の場所を切り取る、新たなゲノム編集用ヌクレアーゼの探索技術を独自に確立しました。エメンド社では、この新たな探索技術を「OMNIプラットフォーム」と名付け、この技術によって作出されるヌクレアーゼを「OMNIヌクレアーゼ」と呼んでいます。多くの細菌などから新たな特徴を持ったOMNIヌクレアーゼを数多く作出しています。様々な遺伝子疾患について、その疾患と遺伝子変異の分子機構の理解に基づき、疾患に応じてゲノム編集戦略を構築し、数多くのOMNI ヌクレアーゼの中から適切なヌクレアーゼを選択し、それをさらに標的配列に対して最適化します。。
また、アレル特異的遺伝子編集を可能にしている点です。OMNIプラットフォームの技術により、基本的に同じ塩基配列の父方と母方の対(つい)をなす対立遺伝子の、わずかな違いを確実に識別し、一方を傷つけることなく、これまで治療が困難であった異常のある遺伝子のみをターゲットにして編集できるようになりました。このような遺伝子編集技術により、片方の遺伝子だけに異常がある数多くの顕性遺伝性疾患を初めて治療することが可能となり、Emendo社の技術によりゲノム編集による治療の適用範囲が広がります。
Emendo社の持つ遺伝子編集技術の名称はなんですか?
「OMNI™ nuclease」(OMNI遺伝子編集技術)といいます。
合わせてこちらのブログもご参照ください。
Emendo社取得による具体的な計画の発表はいつになりますか?
Emendo社はゲノム編集の領域において次世代プラットフォーム技術を持っており、その点も考慮して、2020年にEmendo社を子会社化いたしました。その後のEmendo社のビジネスプランについては検討を進めております。弊社としては、Emendo社のプログラムを早く成就させることが喫緊の課題であり、ゲノム編集の領域で、世界のトップレベルを維持できる研究開発を継続し、然るべき時に皆さまへ展望をお知らせしたいと思っております。
Emendo社プロジェクトの重症先天性好中球減少症の現在の治療法との相違また、開発スケジュール感を教えてください。
現在の治療法は、ST合剤(抗生剤、スルファメトキサゾール・トリメトプリム)による予防が一義的に大事とされております。 また、感染症がコントロールできない場合にはG-CSF※を使用して好中球の誘導を促します。 但し、高用量の場合は、骨髄異形成症候群や急性骨髄性白血病への移行に細心の注意を払う必要がございます。また、造血幹細胞移植のケースもございます。 Emendo社の手法は、ゲノム編集によって正常な活性を有するエラスターゼを発現させることによって好中球の機能を改善回復させるもので、まさに根本治療に当たります。スケジュール感ですが、現在、FDAと協議をして臨床入りを検討しています。 ※G-CSF 顆粒球コロニー刺激因子:サイトカインの一種で顆粒球産出の促進、好中球の機能を高める作用がある。
Emendo社の臨床試験開始時期はどのぐらいになりそうですか?
また、何年後までいくつぐらいのパイプラインを想定していますか?
ELANE関連重症先天性好中球減少症に関しては、Pre IND※を前提に、FDAと交渉を進めているところでございますが、かなりの時間を要すると考えております。 ELANEをはじめ先天性の疾患は、患者さんによりそれぞれ変異する遺伝子の位置は違います。それを検討した上でさらに進めているということになりますので、1人1人パーソナルにというよりも、できるだけ類型化した形での治療を進めていくということになるかと思います。その上で何が大切かというと、造血幹細胞を取り出し、それにゲノム編集により正常に機能するかどうかを含め、体外で検証した上で、最終的に患者様の体内に戻すということになります。この過程が、FDAの中では今まで必ずしもオーソライズされていなかったため、この過程の精査をしていくというところで、かなりの時間を要すると考えます。したがいまして、具体的な時期について明言は控えさせていただきますが、2030年までの間に数個のパイプラインを作ることを目標に、希少疾患を対象とした開発を迅速に進めて、上市を目指したいと考えてございます。 ※INDとは:Investigational New Drugの略で、米国における臨床試験実施申請資料のこと。米国では、臨床試験を実施する際にはあらかじめ、INDをFDA(食品医薬局)に提出し、試験実施の承認を得ることが義務付けられています。
マイクロバイオーム事業
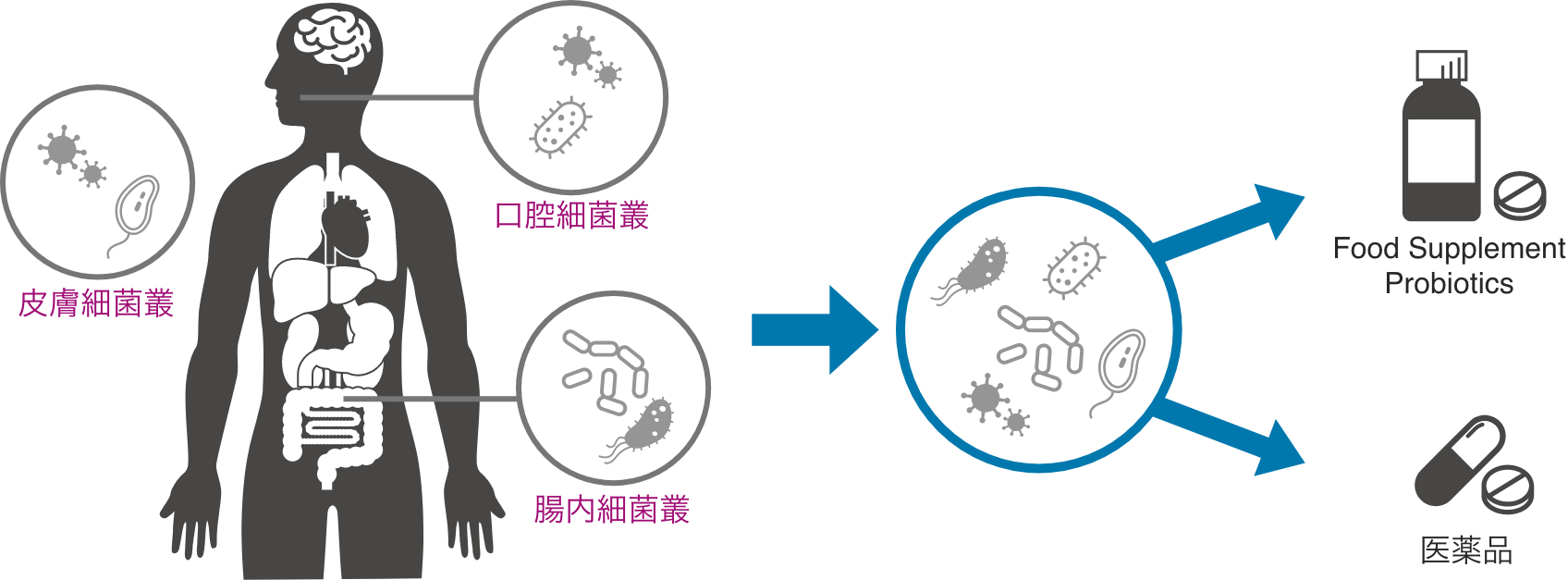
マイクロバイオームとはなんですか?
マイクロバイオームは、ヒト微生物叢のゲノムとそれが発現する遺伝子群および微生物叢とヒトの相互作用を含む広い概念を表しています。この微生物叢とヒトは共生しており、ヒトの身体は微生物叢との集合体といえます。
近年では生活習慣の変化がマイクロバイオームの生理状態の変化を誘導しそれが各疾患の原因に関係しているとの報告があり、菌を活用して医療やヘルスケアに役立てるための研究が行われています。
MyBiotics社(MyBiotics Pharma Ltd.)とは、どのような会社ですか?
2014年6月に設立された、マイクロバイオーム領域のパイオニアで、イスラエルのバイオ企業。世界に先駆けて腸内細菌を含む常在菌の培養、製剤化において、その品質や腸内における生存率を向上させる技術を開発しています。これは、マイクロバイオーム医薬の実用化に必須の重要な技術であり、同社はマイクロバイオームの事業化競争において高い優位性を持っています。当社とは2018年7月に資本提携しています。
MyBiotics社の技術のすごいところはどんな点ですか?
MyBiotics社では、あらゆる民族、年齢性別関係なく、さらに病気や慢性疾患の治癒や健康サプリや薬品としての目的など、世界初となる1人1人にパーソナライズされた腸内細菌を生成することを可能にする『MB Select』というプロジェクトを進めています。2020年1月に、このプロジェクトが専門家の厳正な審査を経て評価され、EIC Accelerator Pilotの資金援助先に選抜されました。
合わせてこちらのブログをご参照ください。
希少遺伝性疾患のスクリーニング事業関連
アンジェスクリニカルリサーチラボラトリー(ACRL)とは、なんですか?
アンジェスクリニカルリサーチラボラトリー(ACRL)は、希少遺伝性疾患検査を主目的とした衛生検査所*で、2021年4月に開設しました。衛生検査所:人体から採取され又は排出された検体の検査を行う施設で、臨床検査技師等に関する法律に基づき登録された施設。
なぜ、アンジェスクリニカルリサーチラボラトリー(ACRL)を設立したのですか?
希少遺伝性疾患も治療が可能なものが増えていますが、治療が可能であっても、病気の進行を止める治療の場合は、症状が出る前に治療を始めないと、望ましい治療効果が得られないことがあります。また、発症しないと通常の診断では発⾒が難しい疾患もあります。希少遺伝性疾患の治療は、発症早期、望ましくは発症前から開始することが重要です。ACRLでは、全国で無料で実施される新生児のマススクリーニング検査の対象疾患以外の遺伝子の変異が原因で起こる疾患の追加スクリーニング検査を受託しており、希少遺伝性疾患の早期発見に努めております。
希少遺伝性疾患の追加検査とはなんですか?
新生児の遺伝子の変化が原因で起こる疾患(希少遺伝性疾患)のうち、無償で実施される「新⽣児マススクリーニング」に含まれない疾患の可能性を判断するための有償の検査です。
希少遺伝性疾患の追加検査を依頼するには、どうすればいいですか?
各地の対応医療機関にご連絡ください。検査に必要な血液は、原則として「新⽣児マススクリーニング」のための採血時に少量の血液を追加で採取するため、赤ちゃんの負担を最小限にできます。
希少遺伝性疾患の追加検査出来る疾患はなんですか?
ムコ多糖症I型、II型、IVA型、VI型、ファブリー病(男児のみ)、ポンペ病、副腎白質ジストロフィー(男児のみ)、脊髄性筋萎縮症(SMA)、重症複合免疫不全症の9つの疾患です。
希少遺伝性疾患の追加検査の検査結果は、どれくらいの期間で分かりますか?
1か月検診時に受診した医療機関で結果をご確認いただけます。
陽性の結果が出たらどうなりますか?
受診した医療機関にご相談ください。
スクリーニング事業の最高売上高をどう見ていますか?
この新生児スクリーニング事業単体でというわけではなく、治療法との組み合わせで事業を体系化していきたいと思ってございます。今までの実績で、主に首都圏で月約1,000件の検査を実施しています。さらにこの1,000件の測定をさらにどこまで伸ばせるかというのは受託先の拡大や測定機器等のケイパビリティを見ながら、また新生児スクリーニングの需要を見ながら判断していきたいと思っております。
(今後)マススクリーニングの対象外となる希少疾患の治療薬を作っていくことになるのでしょうか?
将来的にはポンぺ病やムコ多糖症など、マススクリーニングの対象外となる疾患を対象に検討してまいりたいと思っております。
希少疾患治療薬「ゾキンヴィ」
「ゾキンヴィ」とはなんですか?
早老症といわれる、「ハッチンソン・ギルフォード・プロジェリア症候群(HGPS)」及び「プロセシング不全性のプロジェロイド・ラミノパチー(PL)」を対象疾患とした、希少疾患治療薬です。ゾキンヴィは、HGPS の死亡リスク低減、プロセシング不全性早老性PLの治療薬として、2020年11月に米国で承認されました。当社は、2022年5月に、米国の製薬企業Eiger BioPharmaceuticals Inc. と、「ゾキンヴィ」について独占販売契約を締結しました。2023年3月に厚生労働省により希少疾病医薬品(オーファン・ドラッグ)の指定を受け、2023年5⽉に「HGPS及びプロセシング不全性のPL」を効能又は効果として承認申請しました。2024年1月に製造販売承認を取得し、2024年4月に薬価基準に掲載され、2024年5月27日に販売を開始いたしました。
「ハッチンソン・ギルフォード・プロジェリア症候群(HGPS)」と「プロジェロイド・ラミノパチー(PL)」とは どのような病気ですか?
新生児期ないし幼年期に発症して、全身の老化が異常な速度で進行する早老症疾患です。 身長、体重の発育が乏しく、強皮症などの皮膚老化、脱毛、骨格・歯の形成不良をもたらします。 また、重篤な心機能障害や脳血管障害を招きやすく、平均寿命は約14.5年です。
ゾキンヴィの有効性・安全性はどうなのですか?
ゾキンヴィは、ハッチンソン・ギルフォード・プロジェリア症候群(HGPS)の患者において、死亡率を72%減少させ、平均生存期間を4.3年延長させるというデータがあります。 また、安全性については、多くのプロジェリア患者が10年以上にわたってゾキンヴィ治療を継続しており、 報告された副作用はそのほとんどが軽度または中等度のものです。
ゾキンヴィについてアンジェスの役割はどのようなものですか?
日本国内において承認取得手続きを行い、厚生労働省より日本国内の製造販売承認を取得し、販売をしています。
当社の事業目的である「治療法がない疾病分野や難病、希少疾患などを対象にした革新的な医薬品の開発を通じて、国民生活や医療水準の向上に貢献すること」に合致した製品で、今後も日本のドラッグ・ロス解消に貢献したいと考えています。
なぜ、アンジェスがゾキンヴィの取り組みを始めたのですか?
当社は事業目的として、「治療法がない疾病分野や難病、希少疾患などを対象にした革新的な医薬品の開発を通じて、国民生活や医療水準の向上に貢献することを目標としており、そのためにも国際的に通用する革新的な医薬品を少しでも早く患者様にお届けすることを目指して」おり、この事業目標に合致する製品であるからです。
また、当社の希少遺伝性疾患検査事業とのシナジー効果を期待しています。 当社は、2021年からアンジェスクリニカルリサーチラボラトリー(ACRL)において「新⽣児マススクリーニング」の対象疾患以外の、遺伝子の変異が原因で起こる疾患の追加スクリーング検査(希少遺伝性疾患検査事業)を開始しました。このACRLにおいて、治療薬が存在する遺伝性疾患患者発見のための診断検査を拡充する一環として、ゾキンヴィの販売に合わせHGPSとプロセシング不全性PLの検査も開始しました。