11月22日(金)発表リリースの補足解説をします
2019年11月22日(金)、HGF遺伝子治療用製品「コラテジェン®」米国での新しいガイドラインに基づく閉塞性動脈硬化症を対象とした臨床試験開始のお知らせを発表させていただきました。
このリリースにある内容から、
閉塞性動脈硬化症
日本国内の承認は、慢性動脈閉塞症
血管治療に関する新しいガイドライン
など解説をさせていただきたいと思います。
まず、以下の図をご覧ください。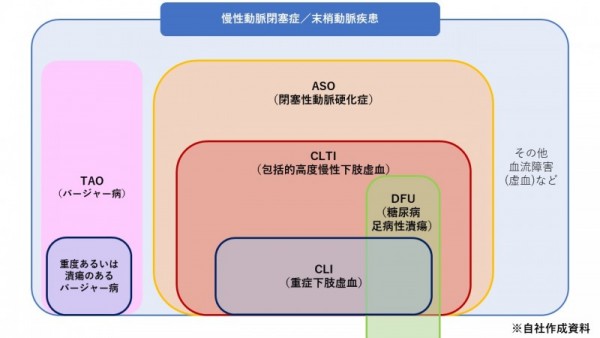
日本国内における条件及び期限付き承認は、慢性動脈閉塞症における重症虚血肢つまりCLIの患者と重度あるいは潰瘍のあるバージャー病の患者を対象にしています。また、以前までの米国での臨床試験はCLIの下肢切断リスクの高い患者を対象に行っていました。
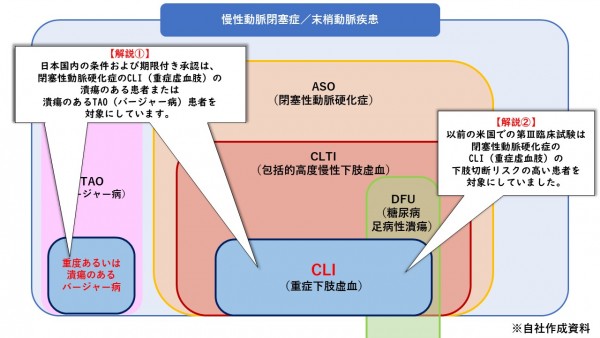
しかし、2019年6月改定されたGVG™(Global Vascular Guidelines)の新しいグローバルガイドラインでは、血管疾患の臨床診療において、まさに足を切断するかしないかを迫られるまでの重度血管疾患であるCLIの患者だけを対象にするのではなく、血管疾患の中でも比較的高度だと言われるCLTIの観点から治療法を見つめなおさなければいけないという考え方が推奨されるようになりました。
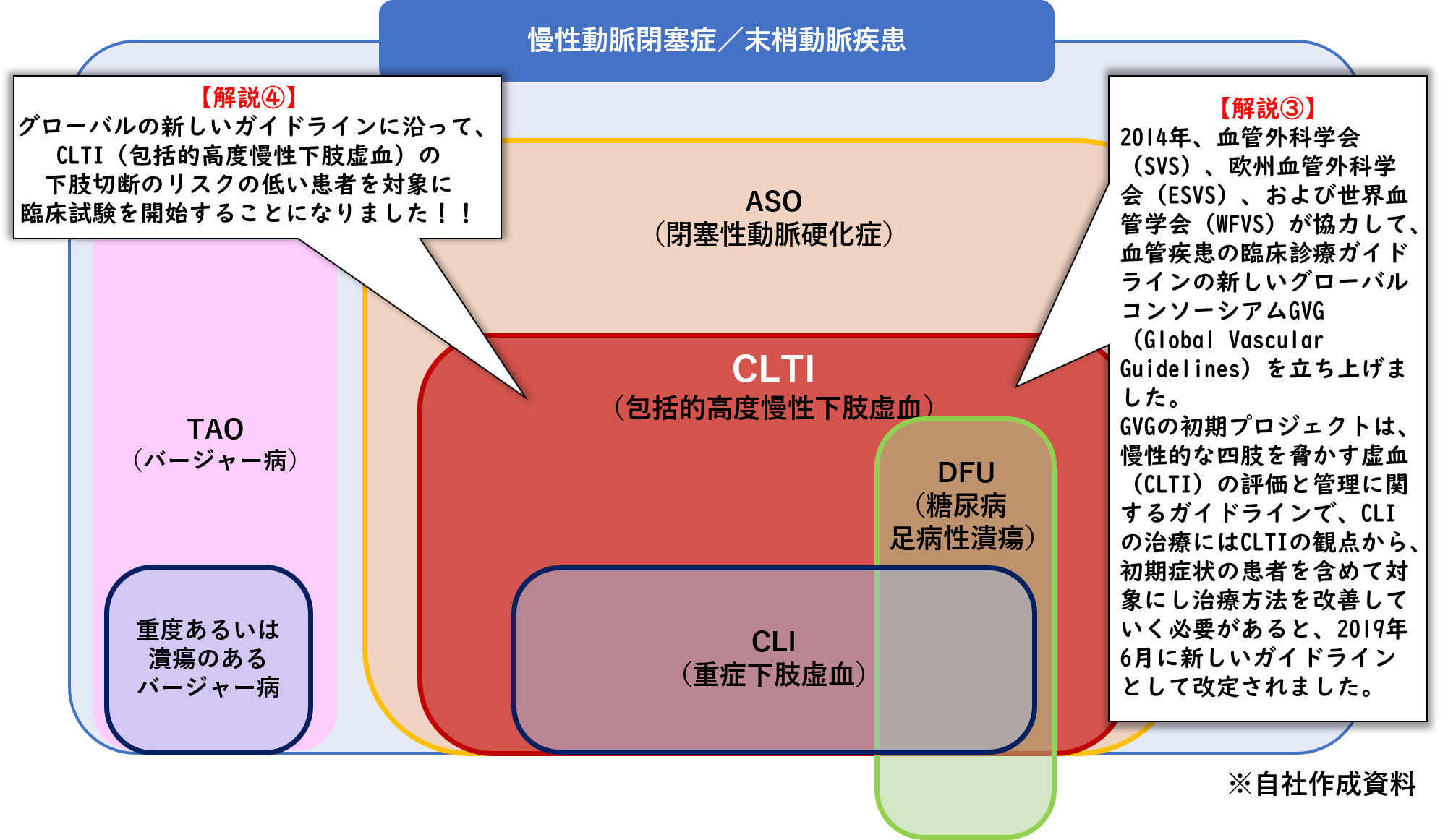
まさに新しいガイドラインに改定したGVG™のメンバーでもある米国UCSFのM. Conte教授らが当社の米国臨床試験申請へのアドバイザーとしても深くかかわってくださり、FDAと相談の上、CLTI(包括的高度慢性下肢虚血)の下肢切断リスクの低い人にまで範囲を広げて、後期第II相臨床試験から確実に進めるということに至りました。この治験は約60の症例数を2年以内に完了させ、最終治験に臨みたいと思っています。
私たちはまさに前例のない未曾有のチャレンジをしている最中であり、最短で進められるように最善を尽くすだけです。
それでも、私たちのこのチャレンジが、GVG™のメンバーでもあるM. Conte教授をはじめとする世界中の血管治療の権威者らから大きな期待と注目をされていることは間違いありませんし、私たちのチャレンジが、重度の虚血症に悩む人々から待たれていることも間違いありません。
私たちのこのチャレンジをご理解いただき、引き続き応援してくださると幸いです。
最後まで読んでいただきまして、ありがとうございました。
